Хомерики Н.М., Хомерики С.Г. Факторы, влияющие на чувствительность уреазного теста при диагностике хеликобактерной инфекции // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2003. — Т. 13. — №3. —Прил. № 19. — С.20-21.
Центральным объектом большого числа научных исследований в области гастроэнтерологии, начиная с середины прошлого столетия, стала париетальная клетка. Вслед за открытием на ней гистаминовых рецепторов и созданием первых Н2-блокаторов пришло осознание того, что наиболее оптимальной мишенью для селективного подавления кислой желудочной секреции является водородно-калиевая АТФаза. Путем химических модификаций пиридин-2-ацетамида, который первоначально предполагалось использовать как антивирусное средство, был получен пиридин-2-метилтиобензимидазол, а затем тимопразол. Эти субстанции обладали выраженной антисекреторной активностью, не зависящей от гистаминовых рецепторов, но связанной с подавлением активности водородно-калиевой АТФазы париетальных клеток [1]. В 1979 г. на основе этих соединений был синтезирован, а в 1988 г. был разрешен к клиническому применению омепразол.
Бурный прогресс в создании антисекреторных средств был обусловлен также открытием в 1983 г. этиологической роли Helicobacter pylori в развитии хронического гастрита и язвенной болезни двенадцатиперстной кишки [2]. Оказалось, что повышение внутрижелудочного рН является обязательным условием для оптимального действия антибактериальных препаратов, включаемых в курс антихеликобактерной терапии. Антисекреторные препараты надежно подавляют секрецию соляной кислоты париетальными клетками и длительно удерживают в желудке нейтральные значения рН, при которых антибиотики медленнее деградируют и дольше оказывают свое бактерицидное и бактериостатическое воздействие. Антацидные препараты в этом плане не могут составить конкуренции антисекреторным средствам.
Механизм действия невсасывающихся антацидов на основе препаратов алюминия (фосфат, гидроокись) связан с адсорбцией уже высвободившейся из париетальных клеток соляной кислоты и ее последующей медленной нейтрализацией. Препараты катионной группы, к которым относится фосфат алюминия, не приводят к изменению кислотно-щелочного баланса крови, не вызывают повышения рН желудочного содержимого выше нейтрального значения. Их действие, в отличие от всасывающихся антацидов анионной группы (натрия гидрокарбонат, карбонаты магния и кальция, магния гидроокись), не сопровождается реакцией «рикошета». Невсасывающиеся антациды — это препараты местного действия.
Антисекреторные препараты — обязательный компонент лекарственных схем для эрадикации H. pylori. Круг показаний к проведению антихеликобактерной терапии определен Маастрихтским соглашением [3,4]. Они включают такие широко распространенные заболевания, как язвенная болезнь двенадцатиперстной кишки, функциональная диспепсия, гастроэзофагеальная рефлюксная болезнь, а также поражения гастродуоденальной слизистой оболочки, обусловленные приемом нестероидных противовоспалительных препаратов. Есть данные об успешном использовании антисекреторных средств при панкреатитах [5,6].
Однако широкое использование антисекреторных средств имеет и негативные аспекты. Быстрое снятие с помощью этих препаратов неприятных ощущений при гиперацидных состояниях, большой выбор препаратов и их доступность в аптечной сети все чаще приводят к самостоятельному бесконтрольному приему пациентами антисекреторных средств. Кроме того, сами врачи иногда назначают мощные антисекреторные препараты в виде монотерапии без выяснения статуса пациента по хеликобактерной инфекции, и это дает серьезный повод для беспокойства.
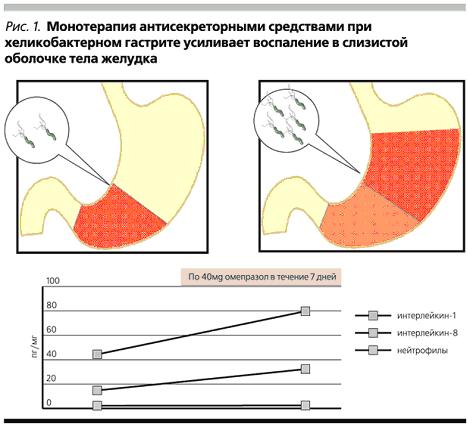
В настоящее время установлено, что прием антисекреторных препаратов в виде монотерапии вне курса антибактериальной терапии и при наличии H. pylori приводит к расширению ареала распространения микроорганизма в желудке. Если при высокой кислотной продукции H. pylori обнаруживается, главным образом, в антральном отделе, то при возрастании внутрижелудочного рН (на фоне монотерапии антисекреторными средствами) этот микроорганизм начинает в большом количестве выявляться и в теле желудка. Это сопровождается выраженным усилением морфологических и иммунологических проявлений воспаления слизистой оболочки желудка (рис. 1). Доказательства тому получены как для Н2-блокаторов [7], так и для ингибиторов протонного насоса [8,9]. К таким же последствиям приводит и продолжение терапии антисекреторными средствами после безуспешно проведенного курса эрадикационной терапии [10,11]. Усиление активности гастрита с вовлечением новых зон слизистой оболочки закладывает основу для хронизации воспаления, развития последующих рецидивов язвенной болезни и гастроэзофагеальной рефлюксной болезни.
Рис.1. Монотерапия антисекреторными средствами при хеликобактерном гастрите усиливает воспаление в слизистой оболочке тела желудка
В таких условиях особое значение приобретает надежная верификация наличия или отсутствия хеликобактерной инфекции в организме при первичном обращении больных до назначения антисекреторных средств либо при контроле эрадикационной терапии. Однако здесь возникли неожиданные препятствия. Оказалось, что при приеме антисекреторных препаратов резко возрастает число ложно-отрицательных результатов дыхательного теста, используемого для контроля эрадикации H. pylori. Это было показано как на фоне приема Н2-блокаторов [12], так и приема ингибиторов протонового насоса [13]. Авторы этих работ связывают снижение чувствительности дыхательного теста с уменьшением степени обсеменения слизистой оболочки желудка микроорганизмами. В основе использования дыхательного теста лежит, как известно, выявление активности уреазных ферментов в популяции микроорганизмов, колонизирующих слизистую оболочку желудка. Между тем, в литературных источниках нет данных о влиянии антисекреторных и антацидных препаратов на чувствительность быстрого уреазного теста с использованием желудочных биоптатов.
В проведенной нами работе установлено, что прием антисекреторных средств, предшествующий диагностическим мероприятиям по выявлению H. pylori, приводит к снижению чувствительности быстрого уреазного теста, тогда как прием антацидных препаратов не влияет на определение активности уреазных ферментов [14].
Нами было обследовано 40 больных с хеликобактерным гастритом, у 12 из которых при эзофагогастродуоденоскопии была выявлена язвенная болезнь двенадцатиперстной кишки или желудка. Для скрининга хеликобактерной инфекции использовался серологический тест — Pyloriset ScreenII (Orion Diagnostica, Финляндия). Всем больным проводился быстрый уреазный тест (PLIVA-Lachema, Чехия), а также цитологическое и гистологическое исследование биоптатов слизистой оболочки желудка. Все больные были разделены на 3 группы (табл.): принимавшие до обследования антисекреторные препараты — 17 пациентов; принимавшие до обследования антацидные препараты (Фосфалюгель; Yamanouchi, Нидерланды) — 13; не принимавшие препараты до обследования — 10 (группа сравнении).
У всех больных первой группы, принимавших ингибиторы протонной помпы или Н2-блокаторы в период от 6 до 30 дней перед эзофагогастродуоденоскопией, в слизистой оболочке желудка цитологическим и гистологическим методами был обнаружен H. pylori. Лишь у трех больных этой группы быстрый уреазный тест дал положительную реакцию (у этих больных была выявлена высокая степень обсеменения H. pylori). Таким образом, у большей части больных имели место ложно-отрицательные результаты быстрого уреазного теста.
Во второй группе больных (прием Фосфалюгеля) и в группе сравнения использование гистологического и цитологического методов также позволило во всех случаях выявить присутствие H. pylori в слизистой оболочке желудка, и это всегда сопровождалось положительной реакцией в быстром уреазном тесте. Интенсивность реакции при этом коррелировала со степенью обсемененности слизистой оболочки H. pylori.
По данным Центрального НИИ гастроэнтерологии, частота ложно-отрицательные результатов различных уреазных тестов при сравнении с данными морфологического исследования составляет от 30% до 55%. Однако сопоставления с приемом пациентами антисекреторных или антацидных средств в этом случае не проводилось, а ложно-отрицательные результаты объяснялись недостаточно высокой чувствительностью использованных методов.
Одной из причин ложно-отрицательных результатов при приеме антисекреторных препаратов является наличие у H. pylori собственного механизма кислотно-щелочного гомеостазирования (см. Таблицу). Известно, что геном H. pylori несет в себе гены, кодирующие как уреазные ферменты (факторы антикислотной защиты), так и ферменты окислительного метаболизма, играющие роль фактора антищелочной защиты (рН >8 губителен для H. pylori). Гиперацидное состояние, развивающееся при хеликобактерном гастрите, приводит к длительному снижению рН в слизистой оболочке желудка. Это побуждает H. pylori направлять весь свой энергетический потенциал на максимальную мобилизацию активности уреазных ферментов. Прием мощных антисекреторных средств приводит к периодическим подъемам рН в слизистой оболочке желудка до значений в интервале 8> pH >6. При приближении к этим значениям энергетический потенциал H. pylori переключается на мобилизацию активности окислительно-восстановительных ферментов. Окисление субстратов в этих реакциях сопровождается генерацией протона, закисляющего окружающую среду.
Между тем, энергетический и пластический потенциал микроорганизма лимитирован — он может синтезировать лишь ограниченное количество того или иного фермента. Поэтому в условиях нейтральной среды H. pylori синтезирует меньше уреаз (которые в этих условиях не нужны) и больше оксидаз (потребность в которых велика), что ведет к снижению выявляемости микроорганизма в уреазных тестах.
Исходя из этого, становится понятным, почему Фосфалюгель не влияет на чувствительность уреазного теста. Этот препарат содержит фосфат алюминия, являющийся невсасывающимся катионным антацидом местного действия. Фосфалюгель быстро повышает рН в слизистой оболочке желудка до 3. На этом уровне кислотности нейтрализующая активность фосфата алюминия практически прекращается. Этого достаточно для купирования гиперацидного состояния, но не приводит к повышению рН желудочного содержимого выше нейтрального значения. Соответственно, при приеме Фосфалюгеля не наблюдается перестройки ферментного метаболизма H. pylori. Этот микроорганизм сохраняет высокую активность своих уреазных ферментов и хорошо выявляется при проведении соответствующих тестов.
Таким образом, в проведенном нами исследовании впервые установлено снижение чувствительности быстрого уреазного теста на фоне приема ингибиторов протонового насоса и блокаторов гистаминовых Н2-рецепторов, что следует учитывать как на этапе первичной диагностики хеликобактерной инфекции, так и на этапе контроля после курса эрадикационной терапии. Реализация антацидных свойств Фосфалюгеля не изменяет чувствительности уреазного теста, что не препятствует обнаружению H. pylori на любом этапе диагностики.
На этапах диагностического поиска следует отменять антисекреторные препараты, а при необходимости купирования у больных болевого синдрома и явлений гиперацидизма назначать Фосфалюгель в стандартной дозировке до окончательной установки диагноза и назначения этиотропного лечения.
Контроль эрадикации после курса проведенной антихеликобактерной терапии должен осуществляться не менее чем через 2 недели после отмены антисекреторных препаратов. Наличие хеликобактерной инфекции должно служить строгим противопоказанием к монотерапии антисекреторными средствами, о чем обязательно следует информировать пациентов для пресечения практики самолечения.
ЛИТЕРАТУРА
1. Acid related diseases. Biology and Treatment. Ed.: Modlin IM, Sachs G. Schnetztor-Verlag GmbH D-Konstanz, 1998, 368P.
2. Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983;1:1273-5.
3. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997;41:8-13.
4. Ивашкин В.Т., Исаков В.А. Основные положения П Маастрихтского соглашения: какие рекомендации по лечению заболеваний, ассоциированных с Helicobacter pylori, нужны России? // Рос. журн. гастроэнтерол. гепатол. колопроктол. - 2001. - Т. 11. - №3. - С. 77-85.
5. Белоусова Е.А., Златкина А.Р., Никулина И.В. с соавт. Квамател в лечении острого и хронического панкреатита // Клиническая медицина. - 2000. - № 9. - С. 1-4.
6. Хомерики С.Г., Хомерики Н.М. Новые аспекты патогенетического лечения панкреатитов // Русский медицинский журнал. - 2000. - Т. 8. - № 7. - С. 288-290.
7. Meining A, Bosseckert H, Caspary WF, et al. H2-receptor antagonists and antacids have an aggravating effect on Helicobacter pylori gastritis in duodenal ulcer patients. Aliment Pharmacol Ther 1997;11:729-34.
8. Kuipers EJ, Lundell L, Klinkenberg-Knol EC, et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication. N Engl J Med 1996;334:1018-22.
9. Graham DY, Opekun AR, Osato MS, Yamaoka Y, El-Zimaity. Pathogenesis of proton pump inhibitor therapy enhanced H.pylori-induced corpus inflammation. Gut 2002;51(suppl.11):A41.
10. Schenk BE, Kuipers EJ, Nelis GF, et al. Effect of Helicobacter pylori eradication on chronic gastritis during omeprazole therapy. Gut 2000;46:615-21.
11. Морозов И.А., Лукина Е.В., Лопатина И.В., Гринберг А.А. Зависимость темпа репарации кровоточащих язвенных дефектов двенадцатиперстной кишки от эрадикации Helicobacter pylori // Диагностика и лечение заболеваний, ассоциированных с Helicobacter pylori. Мат. П междунар.симпозиума. 1999, с.43-47.
12. Racz I, Nemeth A, Szabo M, Csondes G, et al. Effect of H2-receptor antagonist therapy on bacterial colonization density and 13c-urea breath test results in Helicobacter infected patients. Int J Med Microbiology 2001;291(suppl. 31):F-15.
13. Graham DY, Opekun AR, Yamaoka Y, Osato MS, el-Zimaity HM.Early events in proton pump inhibitor-associated exacerbation of corpus gastritis. Aliment Pharmacol Ther. 2003 Jan;17(2):193-200.
© Copyright AMA Ltd. 2008.
Центральным объектом большого числа научных исследований в области гастроэнтерологии, начиная с середины прошлого столетия, стала париетальная клетка. Вслед за открытием на ней гистаминовых рецепторов и созданием первых Н2-блокаторов пришло осознание того, что наиболее оптимальной мишенью для селективного подавления кислой желудочной секреции является водородно-калиевая АТФаза. Путем химических модификаций пиридин-2-ацетамида, который первоначально предполагалось использовать как антивирусное средство, был получен пиридин-2-метилтиобензимидазол, а затем тимопразол. Эти субстанции обладали выраженной антисекреторной активностью, не зависящей от гистаминовых рецепторов, но связанной с подавлением активности водородно-калиевой АТФазы париетальных клеток [1]. В 1979 г. на основе этих соединений был синтезирован, а в 1988 г. был разрешен к клиническому применению омепразол.
Бурный прогресс в создании антисекреторных средств был обусловлен также открытием в 1983 г. этиологической роли Helicobacter pylori в развитии хронического гастрита и язвенной болезни двенадцатиперстной кишки [2]. Оказалось, что повышение внутрижелудочного рН является обязательным условием для оптимального действия антибактериальных препаратов, включаемых в курс антихеликобактерной терапии. Антисекреторные препараты надежно подавляют секрецию соляной кислоты париетальными клетками и длительно удерживают в желудке нейтральные значения рН, при которых антибиотики медленнее деградируют и дольше оказывают свое бактерицидное и бактериостатическое воздействие. Антацидные препараты в этом плане не могут составить конкуренции антисекреторным средствам.
Механизм действия невсасывающихся антацидов на основе препаратов алюминия (фосфат, гидроокись) связан с адсорбцией уже высвободившейся из париетальных клеток соляной кислоты и ее последующей медленной нейтрализацией. Препараты катионной группы, к которым относится фосфат алюминия, не приводят к изменению кислотно-щелочного баланса крови, не вызывают повышения рН желудочного содержимого выше нейтрального значения. Их действие, в отличие от всасывающихся антацидов анионной группы (натрия гидрокарбонат, карбонаты магния и кальция, магния гидроокись), не сопровождается реакцией «рикошета». Невсасывающиеся антациды — это препараты местного действия.
Антисекреторные препараты — обязательный компонент лекарственных схем для эрадикации H. pylori. Круг показаний к проведению антихеликобактерной терапии определен Маастрихтским соглашением [3,4]. Они включают такие широко распространенные заболевания, как язвенная болезнь двенадцатиперстной кишки, функциональная диспепсия, гастроэзофагеальная рефлюксная болезнь, а также поражения гастродуоденальной слизистой оболочки, обусловленные приемом нестероидных противовоспалительных препаратов. Есть данные об успешном использовании антисекреторных средств при панкреатитах [5,6].
Однако широкое использование антисекреторных средств имеет и негативные аспекты. Быстрое снятие с помощью этих препаратов неприятных ощущений при гиперацидных состояниях, большой выбор препаратов и их доступность в аптечной сети все чаще приводят к самостоятельному бесконтрольному приему пациентами антисекреторных средств. Кроме того, сами врачи иногда назначают мощные антисекреторные препараты в виде монотерапии без выяснения статуса пациента по хеликобактерной инфекции, и это дает серьезный повод для беспокойства.
В настоящее время установлено, что прием антисекреторных препаратов в виде монотерапии вне курса антибактериальной терапии и при наличии H. pylori приводит к расширению ареала распространения микроорганизма в желудке. Если при высокой кислотной продукции H. pylori обнаруживается, главным образом, в антральном отделе, то при возрастании внутрижелудочного рН (на фоне монотерапии антисекреторными средствами) этот микроорганизм начинает в большом количестве выявляться и в теле желудка. Это сопровождается выраженным усилением морфологических и иммунологических проявлений воспаления слизистой оболочки желудка (рис. 1). Доказательства тому получены как для Н2-блокаторов [7], так и для ингибиторов протонного насоса [8,9]. К таким же последствиям приводит и продолжение терапии антисекреторными средствами после безуспешно проведенного курса эрадикационной терапии [10,11]. Усиление активности гастрита с вовлечением новых зон слизистой оболочки закладывает основу для хронизации воспаления, развития последующих рецидивов язвенной болезни и гастроэзофагеальной рефлюксной болезни.
Рис.1. Монотерапия антисекреторными средствами при хеликобактерном гастрите усиливает воспаление в слизистой оболочке тела желудка

В таких условиях особое значение приобретает надежная верификация наличия или отсутствия хеликобактерной инфекции в организме при первичном обращении больных до назначения антисекреторных средств либо при контроле эрадикационной терапии. Однако здесь возникли неожиданные препятствия. Оказалось, что при приеме антисекреторных препаратов резко возрастает число ложно-отрицательных результатов дыхательного теста, используемого для контроля эрадикации H. pylori. Это было показано как на фоне приема Н2-блокаторов [12], так и приема ингибиторов протонового насоса [13]. Авторы этих работ связывают снижение чувствительности дыхательного теста с уменьшением степени обсеменения слизистой оболочки желудка микроорганизмами. В основе использования дыхательного теста лежит, как известно, выявление активности уреазных ферментов в популяции микроорганизмов, колонизирующих слизистую оболочку желудка. Между тем, в литературных источниках нет данных о влиянии антисекреторных и антацидных препаратов на чувствительность быстрого уреазного теста с использованием желудочных биоптатов.
В проведенной нами работе установлено, что прием антисекреторных средств, предшествующий диагностическим мероприятиям по выявлению H. pylori, приводит к снижению чувствительности быстрого уреазного теста, тогда как прием антацидных препаратов не влияет на определение активности уреазных ферментов [14].
Нами было обследовано 40 больных с хеликобактерным гастритом, у 12 из которых при эзофагогастродуоденоскопии была выявлена язвенная болезнь двенадцатиперстной кишки или желудка. Для скрининга хеликобактерной инфекции использовался серологический тест — Pyloriset ScreenII (Orion Diagnostica, Финляндия). Всем больным проводился быстрый уреазный тест (PLIVA-Lachema, Чехия), а также цитологическое и гистологическое исследование биоптатов слизистой оболочки желудка. Все больные были разделены на 3 группы (табл.): принимавшие до обследования антисекреторные препараты — 17 пациентов; принимавшие до обследования антацидные препараты (Фосфалюгель; Yamanouchi, Нидерланды) — 13; не принимавшие препараты до обследования — 10 (группа сравнении).
У всех больных первой группы, принимавших ингибиторы протонной помпы или Н2-блокаторы в период от 6 до 30 дней перед эзофагогастродуоденоскопией, в слизистой оболочке желудка цитологическим и гистологическим методами был обнаружен H. pylori. Лишь у трех больных этой группы быстрый уреазный тест дал положительную реакцию (у этих больных была выявлена высокая степень обсеменения H. pylori). Таким образом, у большей части больных имели место ложно-отрицательные результаты быстрого уреазного теста.
Во второй группе больных (прием Фосфалюгеля) и в группе сравнения использование гистологического и цитологического методов также позволило во всех случаях выявить присутствие H. pylori в слизистой оболочке желудка, и это всегда сопровождалось положительной реакцией в быстром уреазном тесте. Интенсивность реакции при этом коррелировала со степенью обсемененности слизистой оболочки H. pylori.
По данным Центрального НИИ гастроэнтерологии, частота ложно-отрицательные результатов различных уреазных тестов при сравнении с данными морфологического исследования составляет от 30% до 55%. Однако сопоставления с приемом пациентами антисекреторных или антацидных средств в этом случае не проводилось, а ложно-отрицательные результаты объяснялись недостаточно высокой чувствительностью использованных методов.
Одной из причин ложно-отрицательных результатов при приеме антисекреторных препаратов является наличие у H. pylori собственного механизма кислотно-щелочного гомеостазирования (см. Таблицу). Известно, что геном H. pylori несет в себе гены, кодирующие как уреазные ферменты (факторы антикислотной защиты), так и ферменты окислительного метаболизма, играющие роль фактора антищелочной защиты (рН >8 губителен для H. pylori). Гиперацидное состояние, развивающееся при хеликобактерном гастрите, приводит к длительному снижению рН в слизистой оболочке желудка. Это побуждает H. pylori направлять весь свой энергетический потенциал на максимальную мобилизацию активности уреазных ферментов. Прием мощных антисекреторных средств приводит к периодическим подъемам рН в слизистой оболочке желудка до значений в интервале 8> pH >6. При приближении к этим значениям энергетический потенциал H. pylori переключается на мобилизацию активности окислительно-восстановительных ферментов. Окисление субстратов в этих реакциях сопровождается генерацией протона, закисляющего окружающую среду.
| Таблица. Сравнение результатов использования уреазного теста с данными гистологического исследования биоптатов желудка у больных, принимавших антисекреторные и антацидные средства | ||||
| Группы больных | Гистология HP | |||
| +++ | ++ | + | ||
| Контроль (n=10) | Число больных | 2 | 3 | 5 |
| уреазный тест | + | + | + | |
| Принимавшие антисекреторные средства (n=17) | Число больных | 3 | 7 | 5 |
| Уреазный тест | + | - | - | |
| Принимавшие Фосфалюгель (n=13) | Число больных | 2 | 5 | 6 |
| Уреазный тест | + | + | + | |
Между тем, энергетический и пластический потенциал микроорганизма лимитирован — он может синтезировать лишь ограниченное количество того или иного фермента. Поэтому в условиях нейтральной среды H. pylori синтезирует меньше уреаз (которые в этих условиях не нужны) и больше оксидаз (потребность в которых велика), что ведет к снижению выявляемости микроорганизма в уреазных тестах.
Исходя из этого, становится понятным, почему Фосфалюгель не влияет на чувствительность уреазного теста. Этот препарат содержит фосфат алюминия, являющийся невсасывающимся катионным антацидом местного действия. Фосфалюгель быстро повышает рН в слизистой оболочке желудка до 3. На этом уровне кислотности нейтрализующая активность фосфата алюминия практически прекращается. Этого достаточно для купирования гиперацидного состояния, но не приводит к повышению рН желудочного содержимого выше нейтрального значения. Соответственно, при приеме Фосфалюгеля не наблюдается перестройки ферментного метаболизма H. pylori. Этот микроорганизм сохраняет высокую активность своих уреазных ферментов и хорошо выявляется при проведении соответствующих тестов.
Таким образом, в проведенном нами исследовании впервые установлено снижение чувствительности быстрого уреазного теста на фоне приема ингибиторов протонового насоса и блокаторов гистаминовых Н2-рецепторов, что следует учитывать как на этапе первичной диагностики хеликобактерной инфекции, так и на этапе контроля после курса эрадикационной терапии. Реализация антацидных свойств Фосфалюгеля не изменяет чувствительности уреазного теста, что не препятствует обнаружению H. pylori на любом этапе диагностики.
На этапах диагностического поиска следует отменять антисекреторные препараты, а при необходимости купирования у больных болевого синдрома и явлений гиперацидизма назначать Фосфалюгель в стандартной дозировке до окончательной установки диагноза и назначения этиотропного лечения.
Контроль эрадикации после курса проведенной антихеликобактерной терапии должен осуществляться не менее чем через 2 недели после отмены антисекреторных препаратов. Наличие хеликобактерной инфекции должно служить строгим противопоказанием к монотерапии антисекреторными средствами, о чем обязательно следует информировать пациентов для пресечения практики самолечения.
ЛИТЕРАТУРА
1. Acid related diseases. Biology and Treatment. Ed.: Modlin IM, Sachs G. Schnetztor-Verlag GmbH D-Konstanz, 1998, 368P.
2. Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983;1:1273-5.
3. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997;41:8-13.
4. Ивашкин В.Т., Исаков В.А. Основные положения П Маастрихтского соглашения: какие рекомендации по лечению заболеваний, ассоциированных с Helicobacter pylori, нужны России? // Рос. журн. гастроэнтерол. гепатол. колопроктол. - 2001. - Т. 11. - №3. - С. 77-85.
5. Белоусова Е.А., Златкина А.Р., Никулина И.В. с соавт. Квамател в лечении острого и хронического панкреатита // Клиническая медицина. - 2000. - № 9. - С. 1-4.
6. Хомерики С.Г., Хомерики Н.М. Новые аспекты патогенетического лечения панкреатитов // Русский медицинский журнал. - 2000. - Т. 8. - № 7. - С. 288-290.
7. Meining A, Bosseckert H, Caspary WF, et al. H2-receptor antagonists and antacids have an aggravating effect on Helicobacter pylori gastritis in duodenal ulcer patients. Aliment Pharmacol Ther 1997;11:729-34.
8. Kuipers EJ, Lundell L, Klinkenberg-Knol EC, et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication. N Engl J Med 1996;334:1018-22.
9. Graham DY, Opekun AR, Osato MS, Yamaoka Y, El-Zimaity. Pathogenesis of proton pump inhibitor therapy enhanced H.pylori-induced corpus inflammation. Gut 2002;51(suppl.11):A41.
10. Schenk BE, Kuipers EJ, Nelis GF, et al. Effect of Helicobacter pylori eradication on chronic gastritis during omeprazole therapy. Gut 2000;46:615-21.
11. Морозов И.А., Лукина Е.В., Лопатина И.В., Гринберг А.А. Зависимость темпа репарации кровоточащих язвенных дефектов двенадцатиперстной кишки от эрадикации Helicobacter pylori // Диагностика и лечение заболеваний, ассоциированных с Helicobacter pylori. Мат. П междунар.симпозиума. 1999, с.43-47.
12. Racz I, Nemeth A, Szabo M, Csondes G, et al. Effect of H2-receptor antagonist therapy on bacterial colonization density and 13c-urea breath test results in Helicobacter infected patients. Int J Med Microbiology 2001;291(suppl. 31):F-15.
13. Graham DY, Opekun AR, Yamaoka Y, Osato MS, el-Zimaity HM.Early events in proton pump inhibitor-associated exacerbation of corpus gastritis. Aliment Pharmacol Ther. 2003 Jan;17(2):193-200.
© Copyright AMA Ltd. 2008.
