Сравнение неинвазивных методов диагностики Helicobаcter pylori. Опыт применения дыхательного Хелик-аппарата у детей
Кафедра гастроэнтерологии ФПК и ПП СПб ГПМА. Паролова Н.И., Корниенко Е.А., Дмитриенко М.А., Быков С.Э.
2007
Резюме. В настоящее время разработано большое число методов диагностики Helicobаcter pylori, однако ни один из них не обладает 100% чувствительностью и специфичностью [1] , поэтому в научной среде не утрачен интерес к разработке высокочувствительного и высокоспецифичного неинвазивного метода диагностики данной инфекции. Проведенное исследование позволило сравнить реально применяемые в детской гастроэнтерологии неинвазивные методы диагностики хеликобактриоза и выделить наиболее перспективные из них.
Ключевые слова: Helicobаcter pylori, методы диагностики, Хелик-тест, Хелик-аппарат.
Среди всего многообразия методов диагностики Helicobаcter pylori выделяют две большие группы – инвазивные и неинвазивыне методы. Инвазивные методы основаны на взятии биоптатов при проведении фиброгастродуоденоскопии. Неинвазивные методы не требуют проведения эндоскопического исследования (рис1.) [12].
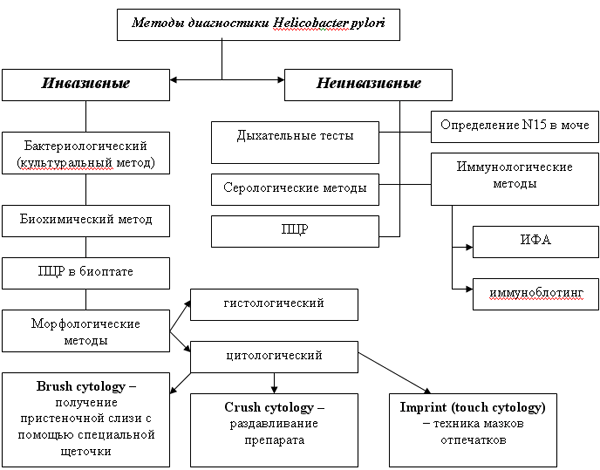
Каждый из методов обладает своей чувствительностью и специфичностью. Под чувствительностью подразумевают вероятность истинно положительного результата при достоверной инфицированности Helicobаcter pylori, а под специфичностью – вероятность истинно отрицательного результата, при отсутствии инфекции.
Остановимся подробнее на неинвазивных методах диагностики Helicobacter pylori.
Среди неинвазивных дыхательных методов выделяют: Urea Breath Test (UBT), ХЕЛИК-тест (с использованием тест-системы ХЕЛИК с индикаторной трубкой или ХЕЛИК-аппарат). В основе дыхательных методов лежит простая химическая реакция, обусловленная способностью Н.pylori гидролизовать мочевину с образованием иона-аммония и бикарбонат-иона. Бикарбонат-ион всасывается в кровь в виде углекислого газа выделяется через легкие. В выдыхаемом из ротовой полости воздуха, регистрируется углерод, входящий в состав углекислого газа, или аммиак. [4]
UBT – тест. Широко применяется в развитых странах. При его проведении используется мочевина, обогащенная С14-изотопом или С13-изотопом. Сравнивается уровень содержания изотопов в выдыхаемом воздухе до нагрузки и после нагрузки раствором мочевины. Увеличение содержания изотопов во второй дозе выдыхаемого воздуха по сравнению с контролем, свидетельствует о наличии Н.pylori. Ложноотрицательный результат может быть при применении антибиотиков, субcтратов висмута, ингибиторов протонной помпы.
Чувствительность метода колеблется от 95 до 97,5%, а специфичность от 93,2% до 100% [1],[2]. Метод прост в исполнении, точен, но его существенными минусами являются низкая портативность, радиоактивность (при определении С14-изотопа), высокая стоимость, требование наличия специально обученного персонала и чрезвычайно дорогого масс-спектроскопа.
Этих недостатков лишены отечественные тест – системы: тест-система ХЕЛИК с индикаторной трубкой и ХЕЛИК-аппарат (ООО «АМА», Санкт-Петербург). Основаны они на оценке уреазной активности в желудке по изменению концентрации аммиака в выдыхаемом воздухе после приема пациентом порции мочевины нормального изотопного состава. Чувствительность метода составляет 95%, а специфичность 92% [3]. Единственным недостатком данного метода является относительная сложность выполнения у детей в возрасте до 5 лет и возможность получения ложноотрицательного результата при применении антибиотиков, субcтратов висмута, ингибиторов протонной помпы.
Определение N15 в моче. Основан на определении изотопа N15 в моче пациента после приема им мочевины. Изотоп входит в состав аммония и может подвергаться количественной оценке. Метод зарекомендовал себя как простой, точный, высокочувствительный и нерадиоактивный [12].
ПЦР. Материалом для исследования могут быть желудочный сок, смывы ротовой полости, зубной налет, копрофильтрат. Наибольшее распространение получил метод ПЦР в кале. С помощью ПЦР-диагностики возможно типировать и дифференцировать штаммы бактерии по патогенности, определить антибиотикорезистентность выделенных культур, а также дифференцировать реинфекцию от рецидива [12].
Чувствительность и специфичность ПЦР в копрофильтрате составляет по различным источникам 61,4-96%, а специфичность – 100%. В западной литературе данный метод обследования рекомендован для использования как в первичной, так и в постэрадикационной диагностике [10] Единственным ограничением широкого использования этого теста в клинической практике остается его высокая стоимость по сравнению с другими методами диагностики хеликобактериоза [11].
Иммунологические методы включают: иммуноферментный анализ, иммунохроматографические тесты, в том числе технику иммуноблотинга и реакцию гемагглютинации. Материалом для исследования служит слюна, кал, моча. Однако эти методы не получили широкого применения в практике из-за невысокой специфичности и используются преимущественно с научными целями. [12].
Серологические методы. Длительное персистирование Helicobacter pylori в организме человека приводит к продукции специфических антител, которые можно выделить с диагностической целью. Наиболее часто используются различные варианты иммуноферментного анализа и наиболее информативным считается определение IgG.
Следует заметить, что безусловным преимуществом данного метода является возможность применения в различных возрастных группах, простота постановки и учета, дешивизна, однако, его диагностическая ценность значительно зависит от используемой тест-системы. Так при использовании тест-сиcтем FlexSure®SmithKline Diagnostics Inc, PA, USA и Medmira®, MedMira Laboratories, Dartmouth, Nova Scotia, Canada чувствительность составляет 59% и 71%, а специфичность 93% и 94% соответственно. [6] [10]. При первичной диагностике Н.pylori-инфекции у детей в ряде случаев отмечается слабый иммунный ответ, а это, в свою очередь, затрудняет верификацию антител против H.pylori. Из-за медленного снижения титра антител после успешно проведенной противохеликобактерной терапии, которое продолжается в течение 6 месяцев, серологический метод, как оказалось, мало пригоден и при раннем контроле лечения как у детей, так и у взрослых. [9][10][11].
В последнее время на основе «сэндвич-метода» и латекс-агглютинации разработаны экспресс-тесты, для проведения которых нужна капля крови. При невысокой стоимости и простоте исполнения, быстром получении ответа и экономичности, экспресс-тесты обладают низкой чувствительностью – от 51% до 75%. [14].
Мы решили проверить чувствительность и специфичность различных неинвазивных методов диагностики хеликобактериоза в детской практике.
Цель исследования:
1. Оценить чувствительность и специфичность отдельных неинвазивных методов диагностики Helicobacter pylori.
2. Оценить эффективность работы ХЕЛИК-аппарата в диагностике Нр-инфекции у детей в сравнении с наиболее распространенными неинвазивными методами диагностики Helicobacter pylori.
Материалы и методы. Исследование проводилось на базе ДИБ№5 им. Н.Ф. Филатова, г. Санкт-Петербург в период с 2004 по 2007 гг. и состояло из двух этапов. На первом этапе обследовано в общей сложности 260 человек. Всем детям проводилась ФЭГДС со взятием биоптатов из антрального отдела и тела желудка с последующим морфологическим исследованием и быстрый уреазный тест (ООО «АМА», Санкт-Петербург), чувствительность которых в совокупности по данным литературы составляет 100% [3]. К группе HP - позитивных относились дети, у которых результаты гистологического и биохимического метода совпадали. UBT-тест был проведен 44 детям, тест-система ХЕЛИК с индикаторной трубкой – 260, серологический метод – 112, Acon H. Pylori Rapid Test Strip (экспресс-тест) – 32, ПЦР в кале – 72 детям. Чувствительность и специфичность методов оценивалась в сравнению с данными гистологического и биохимического методов.
По нашим данным, чувствительность и специфичность UBT-теста составили 93% и 98% соответственно, что приблизительно соответствуют данным литературы. Дыхательная тест-система ХЕЛИК с индикаторной трубкой показала чувствительность 94% и специфичность 93%. Несмотря на 100% специфичность, низкие показатели чувствительности отмечались у серологического метода (58%), и ПЦР в кале (43%). Наименьший показатель чувствительности – 35,4%- показал экспресс-тест в капле крови. Оценить специфичность данного метода не удалось из-за отсутствия H.pylori-отрицательных детей группе, в которой применялся данный метод диагностики.
На втором этапе проводилась оценка эффективности работы ХЕЛИК-аппарата (ООО «АМА», Санкт-Петербург). ХЕЛИК-аппарат – компьютезированный индикатор содержания аммиака в воздухе, извлекаемом из ротовой полости для диагностики инфекции Helicobacter pylori. Принцип действия ХЕЛИК-аппарата основан на биохимическом методе определения инфекции Helicobacter pylori по уреазной активности бактерии (т.е по ее способности быстро гидролизовать карбамид).
Исследование проводилось утром натощак при обязательном соблюдении следующих условий: а) чистка зубов, б) тщательное прополаскивание ротовой полости водой перед исследованием, в) отказ от лекарственных препаратов перед исследованием, г)отказ от спиртных напитков, бобовых (горох, фасоль, чечевица) за сутки до исследования, д) отказ от жевательной резинки и курения минимум за три часа перед тестом.
Пациент принимал раствор фармацевтического карбамида нормального изотопного состава в количестве 500 мг, растворенных в 30 мл чистой воды (не газированной). Образующийся в ходе гидролиза аммиак (аммиак и сопутствующие амины — далее аммиак или NH3) через несколько минут поступал в воздух ротовой полости. ХЕЛИК-аппарат определяет содержание аммиака при помощи высокочувствительного датчика.
Время тестирования составляет 9 минут и делится на два периода: базальный и нагрузочный. Определение содержания аммиака, проводимое в базальный период, осуществляется до начала гидролиза карбамида (пока аммиак не поступил в воздух ротовой полости), а определение содержания аммиака, проводимое в нагрузочный период — во время активного гидролиза карбамида. Таким образом, базальный период, отражающий исходный уровень аммиака в ротовой полости пациента, составляет первые полторы минуты теста. Последующие семь с половиной минут тестирования составляют нагрузочный период и отражают концентрацию аммиака после начала гидролиза карбамида.
В ходе исследования регистрируются пять показателей: 1. AvgBas – средний базальный уровень. 2 AvgBas20 – средний базальный уровень за последние 20 секунд базального времени.3. AvgWork – средний нагрузочный уровень. 4. MaxBas – максимальное базальное значение. 5. VaxWork – максимальное нагрузочное значение
Данные показатели представлены на дисплее ХЕЛИК-аппарата и мониторе компьютера в виде числовых значений – условных единицах.
При оценке результата исследования на ХЕЛИК-аппарате оценивается показатель – средний прирост (разница между показателями AvgWork и AvgBas в условных единицах). Целью нашего исследования являлась оценка средних показателей прироста у детей в зависимости о Нр-статуса ребенка.
С помощью ХЕЛИК-аппарата обследовано 170 детей и подростков с гастродуоденальной патологией в возрасте с 9 до 17 лет. Всем детям также выполнялась ФЭГДС со взятием биоптатов из антрального отдела и тела желудка с последующим морфологическим исследованием, быстрый уреазный тест и дыхательная тест-система ХЕЛИК с индикаторной трубкой (которая на первом этапе исследования показала высокие чувствительность и специфичность). Ребенок относился к группе НР+ при совпадении положительных результатов двух и более методов. НР-отрицательный статус устанавливался при отрицательных результатах всех трех методов.
Для оценки результатов ХЕЛИК-аппарата применялся двухступенчатый критерий. В случаях, когда среднебазальный уровень аммиака больше, чем значение р, то пациент относится к группе HP+, иначе, если среднебазальный уровень меньше, чем р, но значение прироста больше, чем значение параметра q, то пациент также относится к группе HP+. Во всех других случаях пациент принадлежит группе HP-. Параметры p и q по всей выборке составили: p=44, q=5. При этом чувствительность и специфичность этого критерия составила 93% и 82% соответственно.
Результаты:
1. Неинвазивные дыхательные методы диагностики Helicobacter pylori (с использованием UBT-теста и тест-системы ХЕЛИК с индикаторной трубкой) показали высокую специфичность и чувствительность 93% и 94% , 98% и 93% соответственно, что практически не отличается от литературных данных.
2. Низкие показатели чувствительности при 100% специфичности отмечались у серологического метода (58%), и ПЦР в кале (43%).
3. Наименьший показатель чувствительности – 35,4%- показал экспресс-тест в капле крови.
4. Неинвазивный дыхательный метод диагностики Helicobacter pylori с использованием ХЕЛИК-аппарата показал себя высокоспецифичным и чувствительным. Чувствительность метода 93%, специфичность 82% (при небольшой выборке H.pylori-негативных пациентов).
5. ХЕЛИК-аппарат может быть рекомендован в качестве неинвазивного метода диагностики Helicobacter pylori у детей в возрастной группе старше 5 лет.
Литература:
1. Hilpi Rautelin,Philippe Lehours and Francis Megraud. Diagnosis of Helicobacter pylori infection. Helicobacter. Volume 8.Supplement 1, 2003,р 13-20
2. Katarzyna Dzierzanowska-Fangrat, Philippe Lehours. Diagnosis of Helicobacter pylori infection. Helicobacter. Volume 11.Supplement 1, 2006, p 6-10
3.Корниенко Е.А., Эмануэль В.Л., Дмитриенко М.А. Хелпил-тест и Хелик-тест для диагностики хеликобактериоза. Пособие для врачей. 2005., стр.7.
4.Корниенко Е.А. и соавт. Аммиачный дыхательный тест в диагностике инфекции Н.pylori.// Клиническая лабораторная диагностика. – 2000. - №1-. С.41-43.
5. Киушкин АА., Садоков В.М. Значение операционных характеристик теста при выборе метода диагностики инфекции Н.pylori// Экспериментальная и клиническая гастроэнтерология. – 2002. - №4.
6. Lurdes Monteniro, Henry Pierre Doermann. Nonserological diagnostic tests for Helicobаcter pylori. Pathogenesis and host response in Helicobаcter pylori infections. 1997.Chapter 23.pp 215-224.
7.Malfertheiner P.,Leodolter A. Pitfalls in Helicobаcter pylori diagnosis. Helicobаcter pylori. Basic Mechanisms to Clinical Cure 2000. p.123.
8. Murata H, Kawano S. и др.Evaluation of the Pylori Tekttest for detection of Helicobаcter pylori infection in cases with and without eradication therapy//Am. J.Gastroenterol.- 1998, Nov – Vol. 93 (11) – p/ 2102-2105.
9. Velapatino B. Validation of string test for diagnosis of Helicobаcter pylori infections. J.Clin Microbiol 2006;44:976-80
10.Vibeke Wewer and Nicolas Kalach. Helicobаcter pylori infections in pediatrics. . Helicobacter. Volume 8.Supplement 1, 2003,р 61-67
11. Helicobacter pylori - инфекция: современные аспекты диагностики и лечения" (пособие для врачей) Пособие для врачей // "HELICOBACTER PYLORY-инфекция: Современные аспекты диагностики и терапии. Москва 2004 .
12.Ценева Г.Я., Рухляда Н.В. и др. Патогенез, диагностика и лечение инфекций, обусловленной Helicobаcter pylori. Санкт-Петербург, 2003., стр. 39, стр. 40-56.
13.Westblom T.U. Molecular diagnosis of Helicobacter pylori//Immunol. Invest. -1997, Jan-Feb. – Vol.92(8). – P1310-1315
14.Wong .C. et. A. An evaluation of whole blood testing for Helicobacter pylori infection in the Chinese population//Aliment. Pharmacol. Ther. – 2000. – Vol. 14. P. 331-335
Ключевые слова: Helicobаcter pylori, методы диагностики, Хелик-тест, Хелик-аппарат.
Среди всего многообразия методов диагностики Helicobаcter pylori выделяют две большие группы – инвазивные и неинвазивыне методы. Инвазивные методы основаны на взятии биоптатов при проведении фиброгастродуоденоскопии. Неинвазивные методы не требуют проведения эндоскопического исследования (рис1.) [12].

Каждый из методов обладает своей чувствительностью и специфичностью. Под чувствительностью подразумевают вероятность истинно положительного результата при достоверной инфицированности Helicobаcter pylori, а под специфичностью – вероятность истинно отрицательного результата, при отсутствии инфекции.
Остановимся подробнее на неинвазивных методах диагностики Helicobacter pylori.
Среди неинвазивных дыхательных методов выделяют: Urea Breath Test (UBT), ХЕЛИК-тест (с использованием тест-системы ХЕЛИК с индикаторной трубкой или ХЕЛИК-аппарат). В основе дыхательных методов лежит простая химическая реакция, обусловленная способностью Н.pylori гидролизовать мочевину с образованием иона-аммония и бикарбонат-иона. Бикарбонат-ион всасывается в кровь в виде углекислого газа выделяется через легкие. В выдыхаемом из ротовой полости воздуха, регистрируется углерод, входящий в состав углекислого газа, или аммиак. [4]
UBT – тест. Широко применяется в развитых странах. При его проведении используется мочевина, обогащенная С14-изотопом или С13-изотопом. Сравнивается уровень содержания изотопов в выдыхаемом воздухе до нагрузки и после нагрузки раствором мочевины. Увеличение содержания изотопов во второй дозе выдыхаемого воздуха по сравнению с контролем, свидетельствует о наличии Н.pylori. Ложноотрицательный результат может быть при применении антибиотиков, субcтратов висмута, ингибиторов протонной помпы.
Чувствительность метода колеблется от 95 до 97,5%, а специфичность от 93,2% до 100% [1],[2]. Метод прост в исполнении, точен, но его существенными минусами являются низкая портативность, радиоактивность (при определении С14-изотопа), высокая стоимость, требование наличия специально обученного персонала и чрезвычайно дорогого масс-спектроскопа.
Этих недостатков лишены отечественные тест – системы: тест-система ХЕЛИК с индикаторной трубкой и ХЕЛИК-аппарат (ООО «АМА», Санкт-Петербург). Основаны они на оценке уреазной активности в желудке по изменению концентрации аммиака в выдыхаемом воздухе после приема пациентом порции мочевины нормального изотопного состава. Чувствительность метода составляет 95%, а специфичность 92% [3]. Единственным недостатком данного метода является относительная сложность выполнения у детей в возрасте до 5 лет и возможность получения ложноотрицательного результата при применении антибиотиков, субcтратов висмута, ингибиторов протонной помпы.
Определение N15 в моче. Основан на определении изотопа N15 в моче пациента после приема им мочевины. Изотоп входит в состав аммония и может подвергаться количественной оценке. Метод зарекомендовал себя как простой, точный, высокочувствительный и нерадиоактивный [12].
ПЦР. Материалом для исследования могут быть желудочный сок, смывы ротовой полости, зубной налет, копрофильтрат. Наибольшее распространение получил метод ПЦР в кале. С помощью ПЦР-диагностики возможно типировать и дифференцировать штаммы бактерии по патогенности, определить антибиотикорезистентность выделенных культур, а также дифференцировать реинфекцию от рецидива [12].
Чувствительность и специфичность ПЦР в копрофильтрате составляет по различным источникам 61,4-96%, а специфичность – 100%. В западной литературе данный метод обследования рекомендован для использования как в первичной, так и в постэрадикационной диагностике [10] Единственным ограничением широкого использования этого теста в клинической практике остается его высокая стоимость по сравнению с другими методами диагностики хеликобактериоза [11].
Иммунологические методы включают: иммуноферментный анализ, иммунохроматографические тесты, в том числе технику иммуноблотинга и реакцию гемагглютинации. Материалом для исследования служит слюна, кал, моча. Однако эти методы не получили широкого применения в практике из-за невысокой специфичности и используются преимущественно с научными целями. [12].
Серологические методы. Длительное персистирование Helicobacter pylori в организме человека приводит к продукции специфических антител, которые можно выделить с диагностической целью. Наиболее часто используются различные варианты иммуноферментного анализа и наиболее информативным считается определение IgG.
Следует заметить, что безусловным преимуществом данного метода является возможность применения в различных возрастных группах, простота постановки и учета, дешивизна, однако, его диагностическая ценность значительно зависит от используемой тест-системы. Так при использовании тест-сиcтем FlexSure®SmithKline Diagnostics Inc, PA, USA и Medmira®, MedMira Laboratories, Dartmouth, Nova Scotia, Canada чувствительность составляет 59% и 71%, а специфичность 93% и 94% соответственно. [6] [10]. При первичной диагностике Н.pylori-инфекции у детей в ряде случаев отмечается слабый иммунный ответ, а это, в свою очередь, затрудняет верификацию антител против H.pylori. Из-за медленного снижения титра антител после успешно проведенной противохеликобактерной терапии, которое продолжается в течение 6 месяцев, серологический метод, как оказалось, мало пригоден и при раннем контроле лечения как у детей, так и у взрослых. [9][10][11].
В последнее время на основе «сэндвич-метода» и латекс-агглютинации разработаны экспресс-тесты, для проведения которых нужна капля крови. При невысокой стоимости и простоте исполнения, быстром получении ответа и экономичности, экспресс-тесты обладают низкой чувствительностью – от 51% до 75%. [14].
Мы решили проверить чувствительность и специфичность различных неинвазивных методов диагностики хеликобактериоза в детской практике.
Цель исследования:
1. Оценить чувствительность и специфичность отдельных неинвазивных методов диагностики Helicobacter pylori.
2. Оценить эффективность работы ХЕЛИК-аппарата в диагностике Нр-инфекции у детей в сравнении с наиболее распространенными неинвазивными методами диагностики Helicobacter pylori.
Материалы и методы. Исследование проводилось на базе ДИБ№5 им. Н.Ф. Филатова, г. Санкт-Петербург в период с 2004 по 2007 гг. и состояло из двух этапов. На первом этапе обследовано в общей сложности 260 человек. Всем детям проводилась ФЭГДС со взятием биоптатов из антрального отдела и тела желудка с последующим морфологическим исследованием и быстрый уреазный тест (ООО «АМА», Санкт-Петербург), чувствительность которых в совокупности по данным литературы составляет 100% [3]. К группе HP - позитивных относились дети, у которых результаты гистологического и биохимического метода совпадали. UBT-тест был проведен 44 детям, тест-система ХЕЛИК с индикаторной трубкой – 260, серологический метод – 112, Acon H. Pylori Rapid Test Strip (экспресс-тест) – 32, ПЦР в кале – 72 детям. Чувствительность и специфичность методов оценивалась в сравнению с данными гистологического и биохимического методов.
По нашим данным, чувствительность и специфичность UBT-теста составили 93% и 98% соответственно, что приблизительно соответствуют данным литературы. Дыхательная тест-система ХЕЛИК с индикаторной трубкой показала чувствительность 94% и специфичность 93%. Несмотря на 100% специфичность, низкие показатели чувствительности отмечались у серологического метода (58%), и ПЦР в кале (43%). Наименьший показатель чувствительности – 35,4%- показал экспресс-тест в капле крови. Оценить специфичность данного метода не удалось из-за отсутствия H.pylori-отрицательных детей группе, в которой применялся данный метод диагностики.
На втором этапе проводилась оценка эффективности работы ХЕЛИК-аппарата (ООО «АМА», Санкт-Петербург). ХЕЛИК-аппарат – компьютезированный индикатор содержания аммиака в воздухе, извлекаемом из ротовой полости для диагностики инфекции Helicobacter pylori. Принцип действия ХЕЛИК-аппарата основан на биохимическом методе определения инфекции Helicobacter pylori по уреазной активности бактерии (т.е по ее способности быстро гидролизовать карбамид).
Исследование проводилось утром натощак при обязательном соблюдении следующих условий: а) чистка зубов, б) тщательное прополаскивание ротовой полости водой перед исследованием, в) отказ от лекарственных препаратов перед исследованием, г)отказ от спиртных напитков, бобовых (горох, фасоль, чечевица) за сутки до исследования, д) отказ от жевательной резинки и курения минимум за три часа перед тестом.
Пациент принимал раствор фармацевтического карбамида нормального изотопного состава в количестве 500 мг, растворенных в 30 мл чистой воды (не газированной). Образующийся в ходе гидролиза аммиак (аммиак и сопутствующие амины — далее аммиак или NH3) через несколько минут поступал в воздух ротовой полости. ХЕЛИК-аппарат определяет содержание аммиака при помощи высокочувствительного датчика.
Время тестирования составляет 9 минут и делится на два периода: базальный и нагрузочный. Определение содержания аммиака, проводимое в базальный период, осуществляется до начала гидролиза карбамида (пока аммиак не поступил в воздух ротовой полости), а определение содержания аммиака, проводимое в нагрузочный период — во время активного гидролиза карбамида. Таким образом, базальный период, отражающий исходный уровень аммиака в ротовой полости пациента, составляет первые полторы минуты теста. Последующие семь с половиной минут тестирования составляют нагрузочный период и отражают концентрацию аммиака после начала гидролиза карбамида.
В ходе исследования регистрируются пять показателей: 1. AvgBas – средний базальный уровень. 2 AvgBas20 – средний базальный уровень за последние 20 секунд базального времени.3. AvgWork – средний нагрузочный уровень. 4. MaxBas – максимальное базальное значение. 5. VaxWork – максимальное нагрузочное значение
Данные показатели представлены на дисплее ХЕЛИК-аппарата и мониторе компьютера в виде числовых значений – условных единицах.
При оценке результата исследования на ХЕЛИК-аппарате оценивается показатель – средний прирост (разница между показателями AvgWork и AvgBas в условных единицах). Целью нашего исследования являлась оценка средних показателей прироста у детей в зависимости о Нр-статуса ребенка.
С помощью ХЕЛИК-аппарата обследовано 170 детей и подростков с гастродуоденальной патологией в возрасте с 9 до 17 лет. Всем детям также выполнялась ФЭГДС со взятием биоптатов из антрального отдела и тела желудка с последующим морфологическим исследованием, быстрый уреазный тест и дыхательная тест-система ХЕЛИК с индикаторной трубкой (которая на первом этапе исследования показала высокие чувствительность и специфичность). Ребенок относился к группе НР+ при совпадении положительных результатов двух и более методов. НР-отрицательный статус устанавливался при отрицательных результатах всех трех методов.
Для оценки результатов ХЕЛИК-аппарата применялся двухступенчатый критерий. В случаях, когда среднебазальный уровень аммиака больше, чем значение р, то пациент относится к группе HP+, иначе, если среднебазальный уровень меньше, чем р, но значение прироста больше, чем значение параметра q, то пациент также относится к группе HP+. Во всех других случаях пациент принадлежит группе HP-. Параметры p и q по всей выборке составили: p=44, q=5. При этом чувствительность и специфичность этого критерия составила 93% и 82% соответственно.
Результаты:
1. Неинвазивные дыхательные методы диагностики Helicobacter pylori (с использованием UBT-теста и тест-системы ХЕЛИК с индикаторной трубкой) показали высокую специфичность и чувствительность 93% и 94% , 98% и 93% соответственно, что практически не отличается от литературных данных.
2. Низкие показатели чувствительности при 100% специфичности отмечались у серологического метода (58%), и ПЦР в кале (43%).
3. Наименьший показатель чувствительности – 35,4%- показал экспресс-тест в капле крови.
4. Неинвазивный дыхательный метод диагностики Helicobacter pylori с использованием ХЕЛИК-аппарата показал себя высокоспецифичным и чувствительным. Чувствительность метода 93%, специфичность 82% (при небольшой выборке H.pylori-негативных пациентов).
5. ХЕЛИК-аппарат может быть рекомендован в качестве неинвазивного метода диагностики Helicobacter pylori у детей в возрастной группе старше 5 лет.
Литература:
1. Hilpi Rautelin,Philippe Lehours and Francis Megraud. Diagnosis of Helicobacter pylori infection. Helicobacter. Volume 8.Supplement 1, 2003,р 13-20
2. Katarzyna Dzierzanowska-Fangrat, Philippe Lehours. Diagnosis of Helicobacter pylori infection. Helicobacter. Volume 11.Supplement 1, 2006, p 6-10
3.Корниенко Е.А., Эмануэль В.Л., Дмитриенко М.А. Хелпил-тест и Хелик-тест для диагностики хеликобактериоза. Пособие для врачей. 2005., стр.7.
4.Корниенко Е.А. и соавт. Аммиачный дыхательный тест в диагностике инфекции Н.pylori.// Клиническая лабораторная диагностика. – 2000. - №1-. С.41-43.
5. Киушкин АА., Садоков В.М. Значение операционных характеристик теста при выборе метода диагностики инфекции Н.pylori// Экспериментальная и клиническая гастроэнтерология. – 2002. - №4.
6. Lurdes Monteniro, Henry Pierre Doermann. Nonserological diagnostic tests for Helicobаcter pylori. Pathogenesis and host response in Helicobаcter pylori infections. 1997.Chapter 23.pp 215-224.
7.Malfertheiner P.,Leodolter A. Pitfalls in Helicobаcter pylori diagnosis. Helicobаcter pylori. Basic Mechanisms to Clinical Cure 2000. p.123.
8. Murata H, Kawano S. и др.Evaluation of the Pylori Tekttest for detection of Helicobаcter pylori infection in cases with and without eradication therapy//Am. J.Gastroenterol.- 1998, Nov – Vol. 93 (11) – p/ 2102-2105.
9. Velapatino B. Validation of string test for diagnosis of Helicobаcter pylori infections. J.Clin Microbiol 2006;44:976-80
10.Vibeke Wewer and Nicolas Kalach. Helicobаcter pylori infections in pediatrics. . Helicobacter. Volume 8.Supplement 1, 2003,р 61-67
11. Helicobacter pylori - инфекция: современные аспекты диагностики и лечения" (пособие для врачей) Пособие для врачей // "HELICOBACTER PYLORY-инфекция: Современные аспекты диагностики и терапии. Москва 2004 .
12.Ценева Г.Я., Рухляда Н.В. и др. Патогенез, диагностика и лечение инфекций, обусловленной Helicobаcter pylori. Санкт-Петербург, 2003., стр. 39, стр. 40-56.
13.Westblom T.U. Molecular diagnosis of Helicobacter pylori//Immunol. Invest. -1997, Jan-Feb. – Vol.92(8). – P1310-1315
14.Wong .C. et. A. An evaluation of whole blood testing for Helicobacter pylori infection in the Chinese population//Aliment. Pharmacol. Ther. – 2000. – Vol. 14. P. 331-335
